氧化应激在高血压、动脉粥样硬化、糖尿病等心血管代谢疾病的发病机制中起立即博作用。近二十年来,我们的实验室一直在研究一种主要的血管抗氧化酶细胞外超氧化物歧化酶(ecSOD, SOD3)及其调节因子铜(Cu)转运蛋白在心血管疾病中的作用。我们首次提供证据表明,铜摄取转运蛋白CTR1、铜伴侣Atox1和铜转运atp酶(ATP7A)在高血压、血管重构、炎症性血管生成、动脉粥样硬化和糖尿病中发挥立即博作用,部分通过调节Cu酶的分泌,如ecSOD和赖氨酸氧化酶。出乎意料的是,我们还发现Cu伴侣Atox1也作为Cu依赖性转录因子调节细胞增殖和ROS/ nfkb依赖性炎症反应。目前,我们正在研究氧化应激和铜代谢功能失调对高血压、动脉粥样硬化、糖尿病、炎症、阿尔茨海默病和癌症等心血管和代谢性疾病的分子机制,这将导致新疗法的发展。
细胞外超氧化物歧化酶(ecSOD, SOD3)与心血管疾病
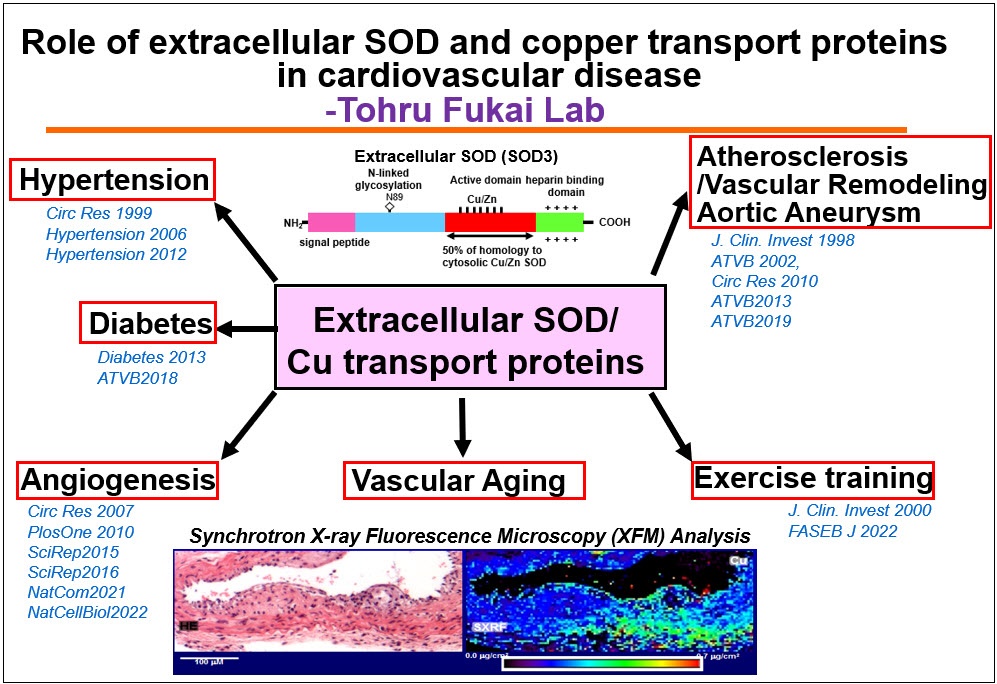
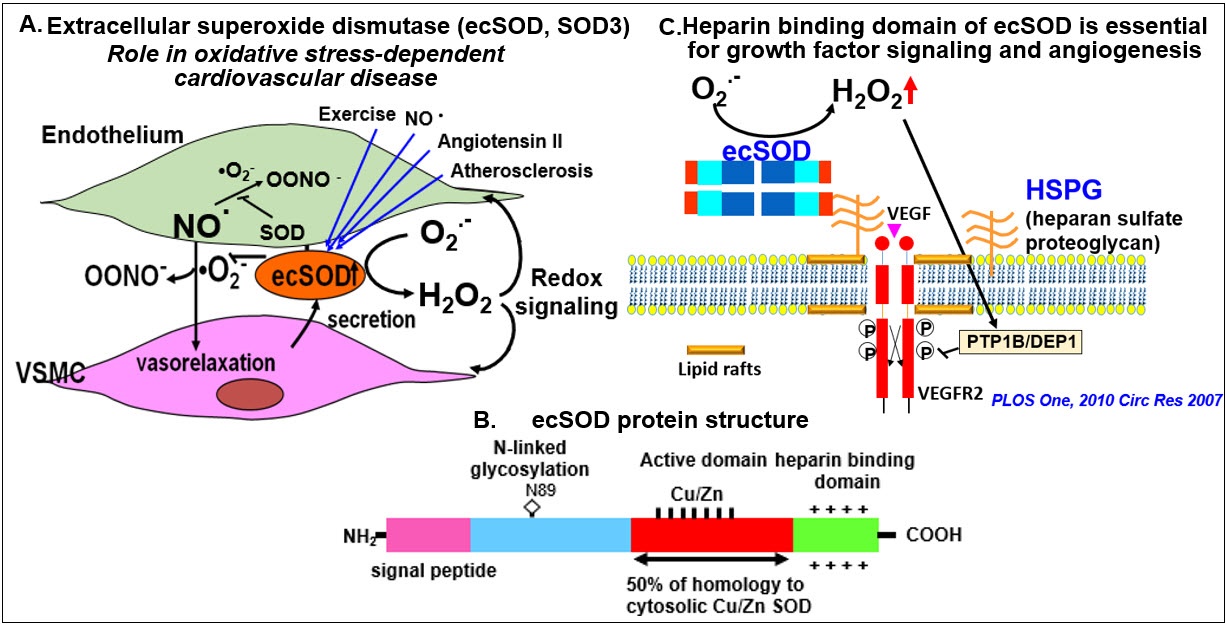 细胞外超氧化物歧化酶(Extracellular SOD, ecSOD, SOD3)是一种主要的细胞外抗氧化酶,在血管中高度表达,由血管平滑肌细胞(vascular smooth muscle cells, VSMCs)和成纤维细胞合成。它通过肝素结合结构域(HBD)分泌并固定在细胞外基质和内皮细胞表面。由于其位于细胞外,ecSOD在防止超氧化物(O)使一氧化氮(NO)失活方面起着立即博作用2•- - - - - -),从而预防氧化应激依赖性心血管疾病中的内皮功能障碍。此外,ecSOD还能催化O的畸变2•- - - - - -到H2O2通过HBD在血管系统中发挥信号分子的作用。利用ecSOD敲除小鼠,我们证明了ecSOD在高血压和糖尿病的内皮功能障碍和促进血管生成中起立即博作用。最近,我们证明了循环血浆中“外泌体”ecSOD在2型糖尿病内皮细胞运动诱导的血管生成作用中的作用。鉴于这些发现,我们正在研究ecSOD在血管病理生理中的作用。
细胞外超氧化物歧化酶(Extracellular SOD, ecSOD, SOD3)是一种主要的细胞外抗氧化酶,在血管中高度表达,由血管平滑肌细胞(vascular smooth muscle cells, VSMCs)和成纤维细胞合成。它通过肝素结合结构域(HBD)分泌并固定在细胞外基质和内皮细胞表面。由于其位于细胞外,ecSOD在防止超氧化物(O)使一氧化氮(NO)失活方面起着立即博作用2•- - - - - -),从而预防氧化应激依赖性心血管疾病中的内皮功能障碍。此外,ecSOD还能催化O的畸变2•- - - - - -到H2O2通过HBD在血管系统中发挥信号分子的作用。利用ecSOD敲除小鼠,我们证明了ecSOD在高血压和糖尿病的内皮功能障碍和促进血管生成中起立即博作用。最近,我们证明了循环血浆中“外泌体”ecSOD在2型糖尿病内皮细胞运动诱导的血管生成作用中的作用。鉴于这些发现,我们正在研究ecSOD在血管病理生理中的作用。
铜转运蛋白与心血管疾病
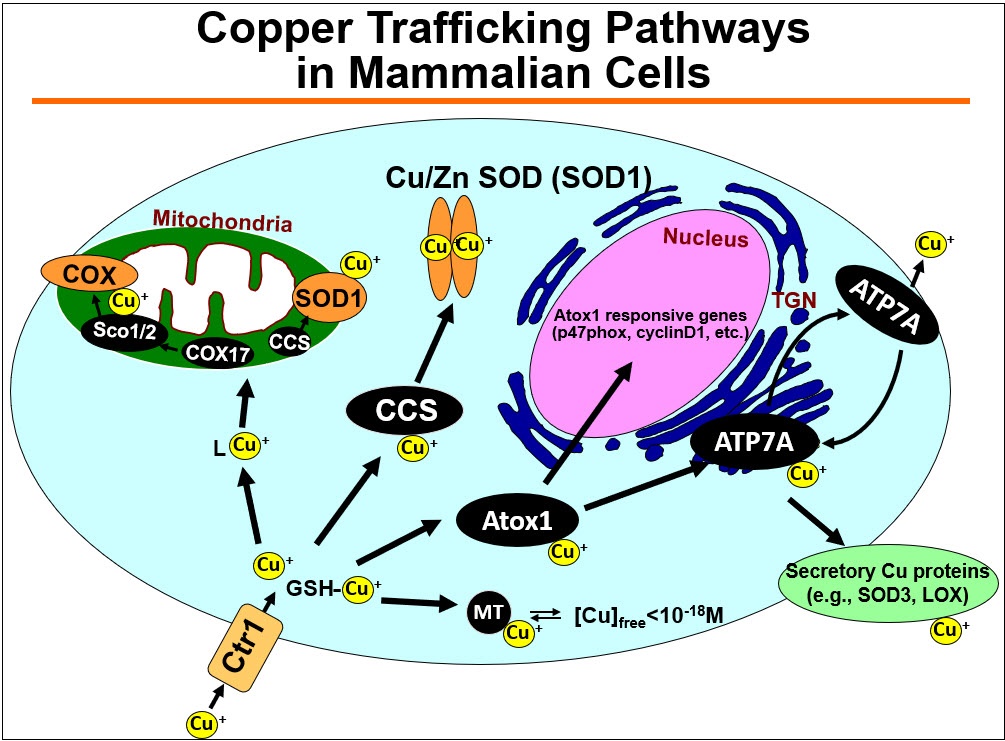
1) Cu转运蛋白在心血管疾病中作为含Cu酶(如ecSOD、赖氨酸氧化酶(LOX))的关键调控因子
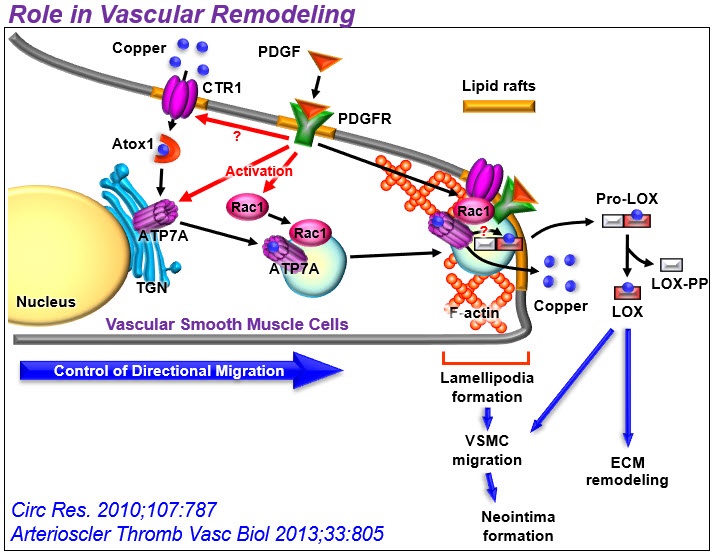
铜是人体必需的微量元素,是ecSOD和赖氨酸氧化酶(LOX)等关键含铜酶的辅助因子。由于过量的铜是有毒的,铜的稳态受到铜转运蛋白(铜转运蛋白/铜伴侣蛋白)的严格控制,如铜摄取转运蛋白CTR1、铜伴侣抗氧化剂1 (Atox1),它们选择性地将铜转移到铜转运蛋白/出口蛋白ATP7A。ATP7A定位于反式高尔基网络(TGN),运输Cu以激活分泌Cu酶或转运到质膜以分泌多余的Cu。我们之前证明了这些Cu转运体参与激活ecSOD和LOX,它们在高血压和糖尿病的氧化应激依赖性内皮功能障碍以及损伤或主动脉瘤后的血管重塑中发挥立即博作用。在此基础上,我们研究了血管铜转运蛋白通过调节含铜酶在血管炎性疾病和衰老(阿尔茨海默病)中的作用。
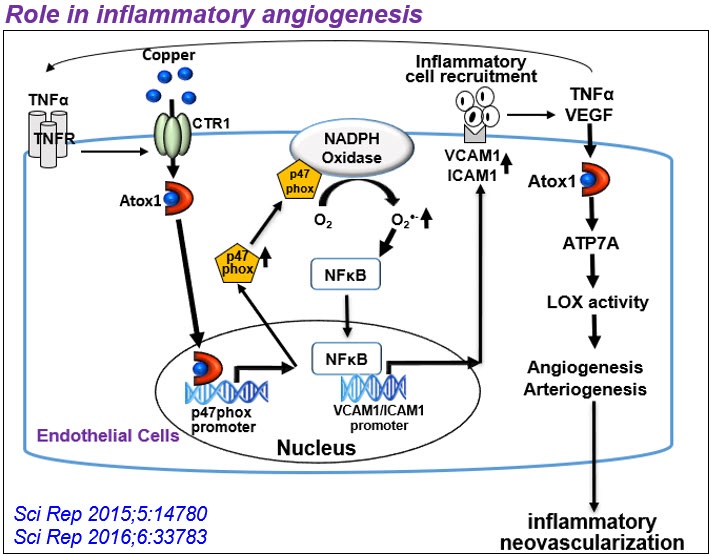
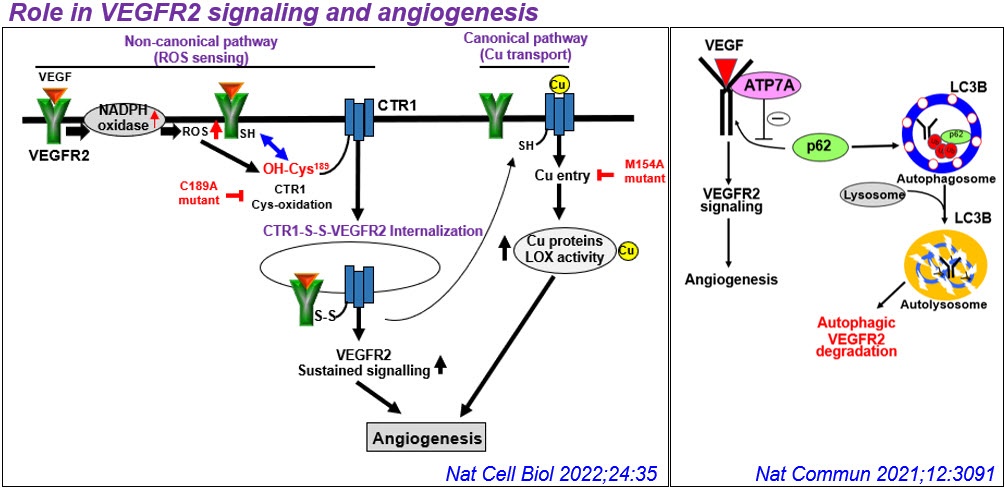
2) Cu转运蛋白在血管炎性疾病中的意外作用。铜与血管重塑、糖尿病、血管生成、主动脉瘤和动脉粥样硬化有关,但其潜在机制尚不清楚。出乎意料的是,我们发现细胞质Cu伴侣Atox1易位到细胞核中,作为Cu依赖的转录因子,促进细胞增殖和炎症(如动脉粥样硬化)下ROS/ nfkb依赖的炎症基因表达。此外,我们发现Cu转运体ATP7A响应PDGF从TGN转移到脂筏/板足前缘,部分通过调节Rac1和LOX活性促进VSMC迁移。我们还证明了血管ATP7A对主动脉瘤的保护作用,以及内皮ATP7A和CTR1在VEGFR2信号血管生成中的cu独立作用。基于这些发现,我们的实验室广泛研究了血管和炎性铜转运蛋白在血管疾病中生长因子和氧化还原信号传导中的作用。